多肽药物具有成药性强、活性高、特异性好、毒性反应相对较弱、不易蓄积、药物交叉反应少等特点。截至目前,全世界范围内已有100多种多肽新药获批上市,用于治疗糖尿病、癌症、骨质疏松、多发性硬化、HIV感染和慢性疼痛等各类疾病(见图1)。此外还有150多种多肽药物处于临床研究阶段,400~600多种多肽药物处于临床前开发阶段。
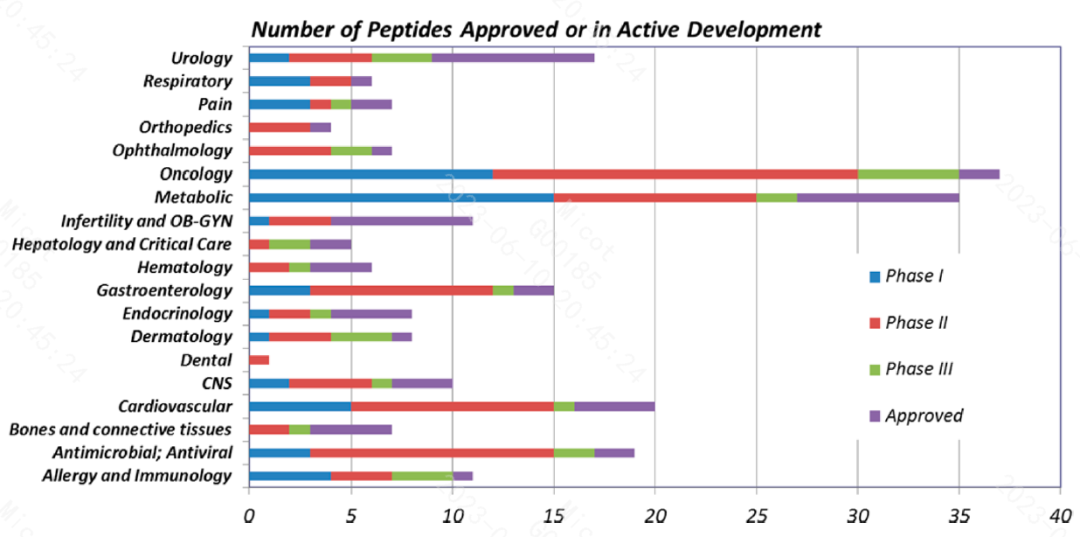
图1 已批准的和处于临床研究阶段的多肽药物适应症分布
据相关机构预测,至2025年全球多肽药物的市场规模可达960亿美元,年复合增长率约8%。,高于全球药品市场的平均增长率。多肽制药领域已出现了多个 “超级重磅炸弹”药物,礼来制药开发的度拉糖肽(Dulaglytide)2022年销售额高达75亿美元,诺和诺德公司的司美格鲁肽(Semaglutide)和利拉鲁肽(Liraglutide)销售额也分别达到109亿美元、19亿美元。2022年5月,礼来制药开发的2型糖尿病治疗多肽药物替西帕肽(Tirzepatide,商品名为Mounjaro,化学结构见图2)被FDA批准上市,鉴于其在治疗肥胖症/超重的全球III期临床试验中表现出的优异减重效果及减肥领域的巨大市场空间,有机构预测其2030前的峰值销售额可达520亿美元,成为有史以来最畅销的药物。随着药物设计、虚拟筛选、高通量合成、结构修饰、制剂工艺等技术的不断完善,多肽制药已经成为创新药开发新的热点。
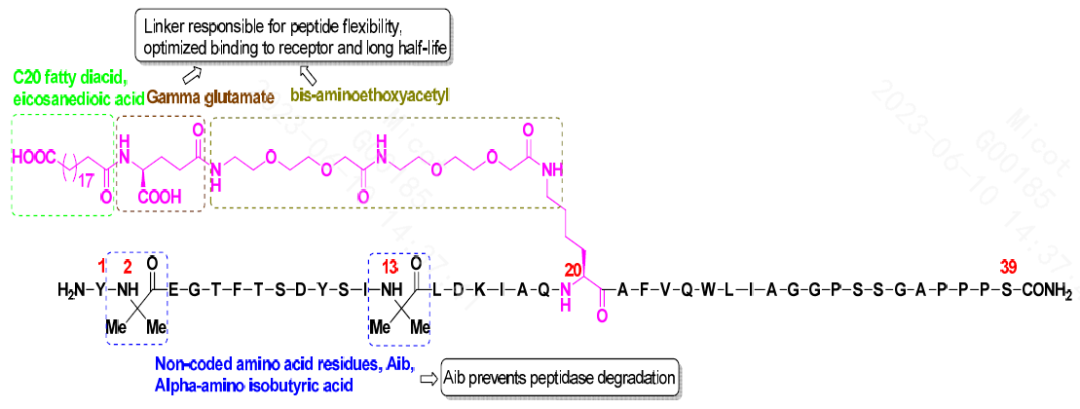
图2 Tirzepatide的化学结构
01、多肽药物的结构确证
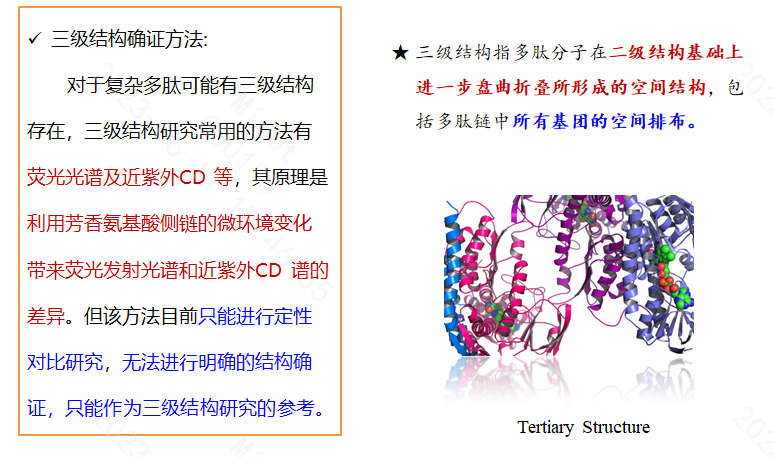
对于多肽药物,除了使用常规的技术手段如质谱(Mass Spectrometry)、红外(Infrared spectrometry)、核磁(Neuclear Magnetic Resonance)等对其结构进行确证外,还需借助其它特殊的技术才能完成结构的有效确证。随着越来越多的多肽药物被批准上市,国内外药品监管机构对于多肽药物结构确证相关法规和指导原则的要求也趋于严格。药品研发企业在开展产品研制和注册申报过程中,应对结构确证相关国内外法规和指导原则的要求进行深入理解,结合新药开发不同阶段的不同要求,适时开展适当的结构确证研究,做到有的放矢,既要避免研究不充分、不全面导致的审评发补风险,又要避免过度研究导致企业研发成本不必要的增加。
02、多肽药物结构确证研究的国内外申报注册法规要求
2.1国外法规要求
2.1.1FDA相关法规

美国FDA于1994年发布了全世界第一个关于合成多肽药物药学研究的指导原则《Guidance for Industry for Submission of Chemistry, Manufacturing, and Controls Information for Synthetic Peptide Substances》,该指导原则首次对合成多肽药物申报注册时结构确证方面的研究提出了具体要求。
合成多肽药物的结构确证至少应包括氨基酸组成分析(Amino acidanalysis)、质谱分析(Mass Spectrometry)及氨基酸序列分析(Peptide sequencing)。氨基酸组成分析可证明该多肽的氨基酸组成是否正确。基于多种技术的质谱,如快原子轰击、电喷雾、场解吸、激光解吸等可提供化合物的相对分子质量及序列信息,同时也可以说明产品中有无相关合成杂质。Edman降解能用于测定多肽的序列,如果N端被保护,则在Edman降解分析前应用适当的方法将N端保护基去掉。如果C端结构的改变,如酰胺化是由合成树脂的修饰引起的,则在多肽定性时,对此可不要求;
如果多肽含有20个以上的氨基酸残基,则需提供肽图(Peptide Mapping)。各片段肽应分离出来并用质谱或序列分析进行定性研究;
当在合成过程中使用了非天然氨基酸(即20个天然氨基酸以外的氨基酸)时,则应提供这些氨基酸(用于氨基酸分析)及其衍生物(用于序列分析)的色谱行为,以证明这些氨基酸存在于合成多肽中;
当多肽结构中存在二硫键时,应与适当的还原剂如二硫苏糖醇反应‚所生成的游离巯基可用适当试剂(如Ellman’s试剂)来检测。如果多肽中存在两个或更多的二硫键,还应确定这些二硫键的正确连接点;
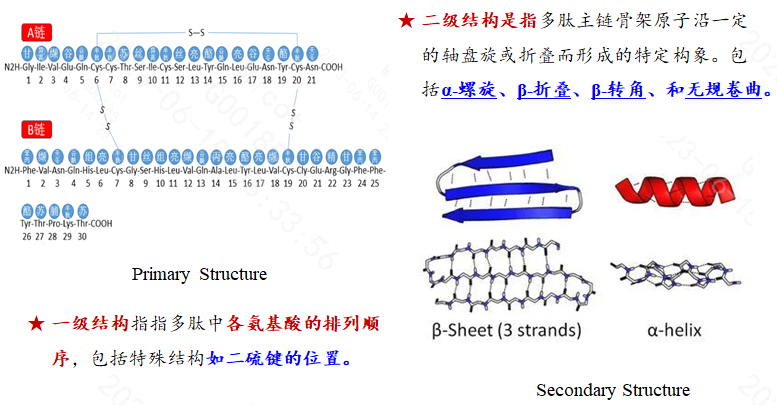
多肽的化学结构可用氢核磁共振1H-NMR及碳核磁共振谱13C-NMR进一步证实。其它用于原料药的结构确证方法均应详细说明【例如圆二色谱Circular dichroism)及荧光光(Fluorescence spectroscopy)】。
对于多肽体外诊断试剂盒,应证明多肽的侧链上已无保护基或确证该保护基的存在。更重要的是还应证明多个抗原决定簇的存在。
2.1.2 USP相关要求

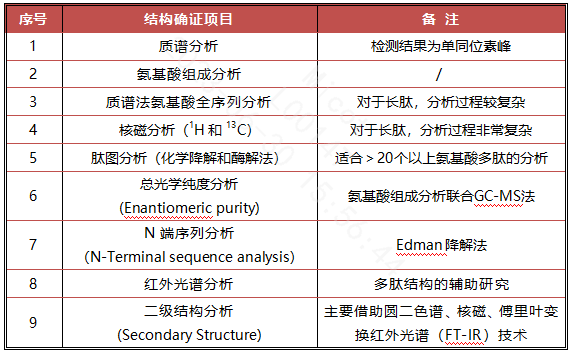
自1994年至今,美国FDA一直未对《合成多肽药物药学研究指导原则》进行更新,但美国另一药品主管技术性机构美国药典委员会(The United States Pharmacopieial Convention)在2023年发布的美国药典通则中公开了《合成多肽原料药的质量属性》【(1503)Quality Attributes of Synthetic Peptide Drug Substances】这一指导性文件,该文件对多肽原料药的结构确证内容提出了比较明确的要求(见表1)。

表1 USP合成多肽原料药应开展的结构确证研究内容
2.1.3 EMA及ICH相关要求


欧洲药品管理局(EMA)和人用药品注册技术要求国际协调会(ICH)目前为止未专门发布过关于多肽药物药学研究相关(含原料药结构确证)的指导原则。EMA仅在2013年发布的《Guideline on setting specifications for related impurities in antibiotics(抗生素类药物相关物质限度制定指导原则)》中对多肽类药物的杂质限度制定给出了具体要求。此外,EMA于2022.09.20发布了有关合成多肽药物研发及生产指南概念文件《Concept Paper on the Establishment of a Guideline on the Development and Manufacture of Synthetic Peptides》,预计未来正式发布的指导原则中会详细阐述结构确证研究相关要求。
2.2国内法规政策要求
2.2.1 SFDA相关法规

我国SFDA于2005年发布的《化学药物原料药制备和结构确证研究技术指导原则》----“合成多肽药物和多糖类药物“章节中,对合成多肽药物结构确证方面的要求进行了初步的阐述。
通过氨基酸组成分析、质谱测定、序列分析以及肽图测绘(含有 20 个
以上的氨基酸残基药物)等实验可基本获得合成多肽药物的结构信息;
药物结构中如有半胱氨酸,应明确其状态(氧化态或还原态),对含有
多个半胱氨酸的多肽药物,应明确二硫键的正确连接位点;
如各步中间体均进行了质谱测定,可根据相关中间体的结构信息,推测出
进行反应的氨基酸的种类;
质谱是多肽药物结构确证的重要手段,紫外、红外、核磁共振、多种流
动相 HPLC、比旋度测定等方法亦可对肽的结构确证提供帮助;
应对目标物的化学纯度和对映体纯度进行研究。
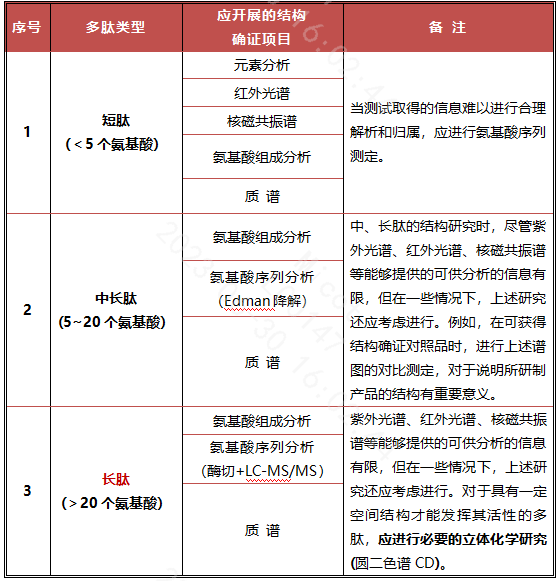
2007年,SFDA首次发布了针对多肽药物开发的《合成多肽药物药学研究技术指导原则》,并在2005年指导原则的基础上对合成多肽药物结构确证方面的要求进行了更为详细的阐述。

该指导原则的最大特点是按多肽药物肽链的长短分别提出了不同的结构确证要求(见表2)。
表2 SFDA多肽指导原则要求开展的结构确证研究内容
2.2.2 NMPA相关法规

2023年2月,NMPA发布了《化学合成多肽药物药学研究技术指导原则(试行)》,该指导性文件并未像2007版的指导原则按多肽化合物的长短对结构确证相关内容进行详细论述,但明确指出了紫外光谱、红外光谱、核磁共振波谱在确证多肽化合物结构时存在的局限性,强调了多肽原料药的一级结构确证中,必须对各氨基酸的连接顺序进行确证,对于具有氨基酸侧链修饰的多肽以及存在两个以上分子内环(如二硫键、酰胺键等)的环肽,应明确具体修饰位点、修饰物结构以及每个内环键的具体连接位点。此外,指导原则还重点强调了对于具有一定高级结构才能发挥其生物活性或缓释作用的多肽创新药物,应分析其高级结构(二级结构、三级结构)对体内生物活性的影响。

03、总结
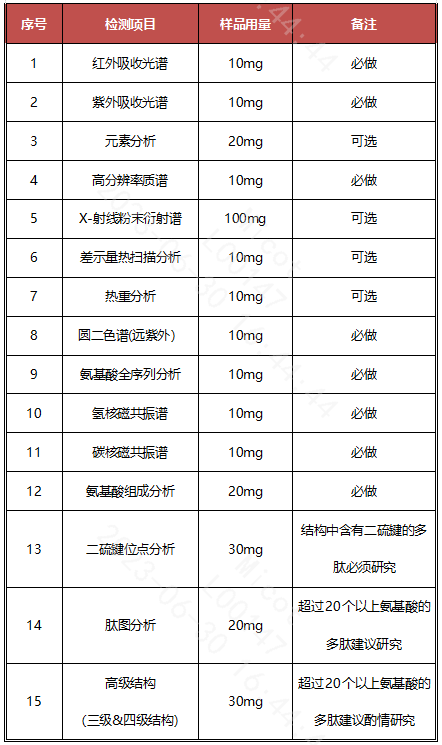
新药研发是一项关乎人民生命健康的神圣事业,国家必须出台各种法规政策以规范和指导各制药企业的研发行为。对于药品研发企业,国内外药品监管机构是第一客户,患者是第二客户(当然还有医生和医保局),只有研究内容符合药品监管机构出台的各项法规和审评要求,满足第一客户的需求,药品才有机会给第二客户使用,最终造福患者。因此,药品研制和申报企业必须紧密跟踪国内外发布的各类药品研发法规政策,熟悉监管要求,做到有的放矢,为企业新药的成功申报提供保证。随着国内外关于多肽药物研发结构确证相关法规的不断完善,以及各类新技术手段的出现,药品监管机构对于多肽药物结构确证的要求也在逐步提高,企业需要结合新药开发不同阶段的不同要求,适时开展适当的结构确证研究(见表3),避免研究不充分、不全面导致的审评发补风险。
表3 多肽药物注册申报建议开展的结构确证研究项目列表
参考文献
[1]Guidance for Industry for Submission of Chemistry, Manufacturing, and Controls Information for Synthetic Peptide Substances.FDA,1994.
[2(1503)Quality Attributes of Synthetic Peptide Drug Substances.USP,2023.
[3]Guideline on setting specifications for related impurities in antibiotics.EMA,2013.
[4]Concept Paper on the Establishment of a Guideline on the Development and Manufacture of Synthetic Peptides.EMA.2022
[5]化学药物原料药制备和结构确证研究技术指导原则.SFDA,2005.
[6]合成多肽药物药学研究技术指导原则.SFDA,2007.
[7]化学合成多肽药物药学研究技术指导原则(试行).NMPA,2023.
注:本文相关图片来源于网络

 企业邮箱
企业邮箱 企业OA
企业OA