蛋白质结构预测领域的人工智能 (AI) 革命不断的在科学的海洋中掀起波澜。同时,由于某些靶点缺少精确的实验认证结构,对以这些靶点为目标进行药物研发的项目造成了一定的阻碍。
2020年底,DeepMind开发的新一代AlphaFold(即AlphaFold2)解决了生物学领域几十年来的重大挑战,实现了基于氨基酸序列精确预测蛋白质3D结构的重大突破。短短半年多后,DeepMind又与合作者公开了由AlphaFold2系统预测的蛋白结构数据库(AlphaFold Protein Structure Database)。该数据库包含了由新一代AlphaFold系统预测的约35万个蛋白结构,其中,在人类蛋白质组方面,AlphaFold2对98.5%的(20296种)人类蛋白的结构做出了预测。这些进展代表了AI技术在单个蛋白结构预测方面取得的一个又一个里程碑。
理解蛋白质蛋白质的相互作用(PPI)对研究蛋白质在疾病中的功能及PPI抑制剂的药物设计至关重要。 今年最先受到关注的是,华盛顿大学的研究团队7月19日在Science杂志上报道的名为RoseTTA fold的蛋白结构预测系统。RoseTTA fold系统突破了AlphaFold2的一个重要局限,不仅可用于基于氨基酸序列预测单一蛋白质的结构,还可以用于预测由两个或者多个蛋白构成的复合体的构象。 RoseTTA fold系统利用IL-12和IL-12受体(IL-12R)的序列预测的IL-12/IL-12R复合体结构与此前利用冷冻电镜解析的结构非常类似。
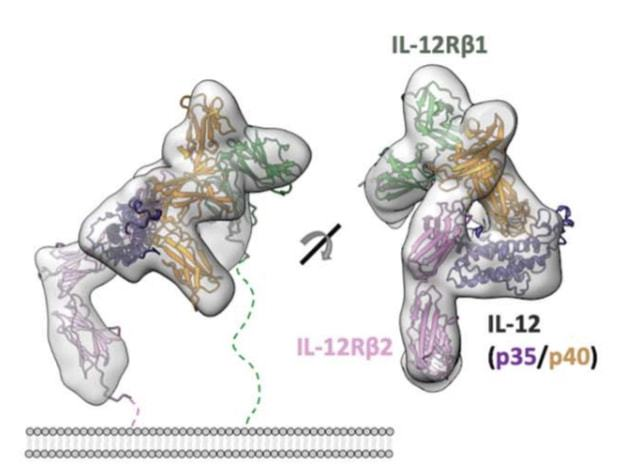
(图片:RoseTTA fold 预测IL-12及IL-12R的复合物结构 (Baek et al. 2021) )
就在本月,科学家们通过联合使用RoseTTA fold和AlphaFold两大系统,成功预测了酵母中大量蛋白质复合物的结构,包括数百个先前结构未知的蛋白质复合物。4个月前,Jumper及其同事在Nature上发布的一项研究描述了他们的新AI系统——AlphaFold-Multimer,该系统绘制了4433种蛋白质复合物的结构。值得注意的是,即使在与模板的氨基酸序列同源性较低的情况下(<30%),该算法仍能准确预测出超过1/3的同源多聚体结构。

(图片:AlphaFold预测同源三聚体(PDB ID:6SK0)的结构与实验数据比对(Jumper et al. 2021))
尽管完全依赖于AI设计的基于癌症免疫疗法的药物(公司:Exscientia)在2020年刚进入临床试验阶段,AI的强大功能已经吸引了众多公司关注其在药物设计、物理化学性质预测的潜力。作为多肽创新药物研发的领头羊——麦科奥特也在密切关注近期AI在蛋白质结构预测的相关动态,同时对探索AI辅助药物设计的可执行能力,抱有巨大的兴趣和期待,正在积极推进进一步的AI辅助药物设计相关工作。
文章参考来源:医药魔方pro《常珊点评 | Science突破:AlphaFold联手RoseTTAFold,翻越蛋白结构预测又一座大山》

 企业邮箱
企业邮箱 企业OA
企业OA