近些年随着生物药的不断发展,生物药的生物学活性分析必不可少,而有些药物即使检测到了结合活性,却没有功能活性,这就需要一个靠谱的检测手段能反应真实的生物学活性情况。报告基因测定法通过模拟体内真实的信号通路与药物作用机制来预测生物学活性水平,准确度高、精密度高,因此在表征和质量控制中得到越来越多的认可和应用。
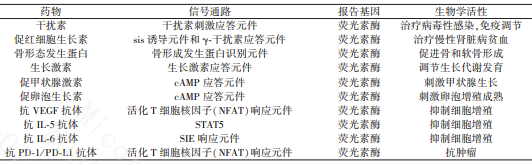
目前各种抗体、细胞因子、激素等生物药均有采用报告基因法以测定其生物活性的报道,具体见表1。
表1. 报告基因法在生物药活性检测领域的应用[1]
概述
报告基因法( Reporter gene assays, RGAs) ,是指先将报告基因融合到宿主细胞中,然后通过外部刺激产生信号,在调控序列控制下,诱导报告基因表达相应产物,通过检测表达产物的信号,可以直观呈现细胞内与基因有关的信号级联的方法。常见的报告基因有荧光素酶(LUC)、氯霉素转乙酰酶(CAT)、绿色荧光蛋白(GFP)、β-内酰胺酶(LAC)、β-半乳糖苷酶(GAL)等[2]。与其他报告基因相比,萤光素酶具有以下优势:①非放射性;②分析方法简单,灵敏度高;③背景低:哺乳动物无内源性荧光素酶表达,而且在宿主细胞及检测试剂中均检测不到背景荧光 [3];④高效,通量大,检测快速;⑤ 市场有多种商品化萤光素酶检测系统可选,这也是荧光素(Luciferase) 报告基因系统的一个重大优势所在。
荧光素酶报告基因以荧光素(Luciferin)为底物来检测荧光素酶(Luciferase)的活性。一般,荧光素检测试剂盒中含有荧光素和细胞裂解液,细胞裂解后会释放出荧光素酶,催化荧光素发出稳定的生物荧光(Bioluminescence),然后通过酶标仪等荧光测定仪检测到。荧光素酶的种类繁多,但目前常用的主要是萤火虫荧光素酶(Firefly luciferase,FLUC)和海肾荧光素酶(Renilla luciferase,RLUC)[4]。
报告基因系统构建方法
报告基因法能检测转录因子与目的基因表达调节序列 (如增强子、启动子)之间的相互作用,转录因子是一种蛋白质,通过识别特定的DNA序列来控制转录,指导基因表达[5]。例如CRE-Luci-293细胞株,CRE是cAMP反应原件(cAMP Response Elements),也是转录因子 CREB(CRE 结合蛋白)识别的DNA结合序列。CREB磷酸化后结合到CRE,启动Luciferase报告基因的表达。其中,CREB是转录因子,它的存在能刺激基因转录,所以又被称为转录增强因子[6]。
该报告系统该如何构建呢?首先,构建一个报告基因质粒,将报告基因序列(荧光素酶表达序列)插入到基因表达调节序列后面;然后,将报告基因质粒与目的基因表达质粒共转染HEK293T细胞或其它细胞系[7,8]。如果此转录因子能够激活靶启动子,则荧光素酶基因就会表达。
信号通路
Luciferase报告基因的信号通路比较复杂,如图1所所示,以GLP-1R 为例,GLP-1R 属于G蛋白偶联受体 B 簇亚族(B1) 的一员,是典型的一个七次跨膜蛋白,在胞内与异源三聚体G蛋白偶联来传递胞外信号。当GLP1与GLP-1R结合,并且被活化后,G蛋白α亚基与β、γ亚基解离,进而启动下游第二信使途径级联,最终通过各种反应元件进行基因转录[9]。GLP1R被激活后,与G蛋白结合,形成GLP1R-G蛋白信号复合物,再与腺苷酸环化酶(AC蛋白)相互作用,诱导第二信使环磷酸腺苷(cAMP,环腺苷3',5'-单磷酸)的产生和积累。随后,cAMP激活蛋白激酶A(PKA),活化的PKA又进一步使CRE结合蛋白CREB磷酸化,活化后的 CREB与CRE序列结合,导致荧光素酶基因转录率升高[4,6],进而诱导报告基因Luciferase的表达。该荧光信号值的高低和GLP-1浓度或活性成正比。
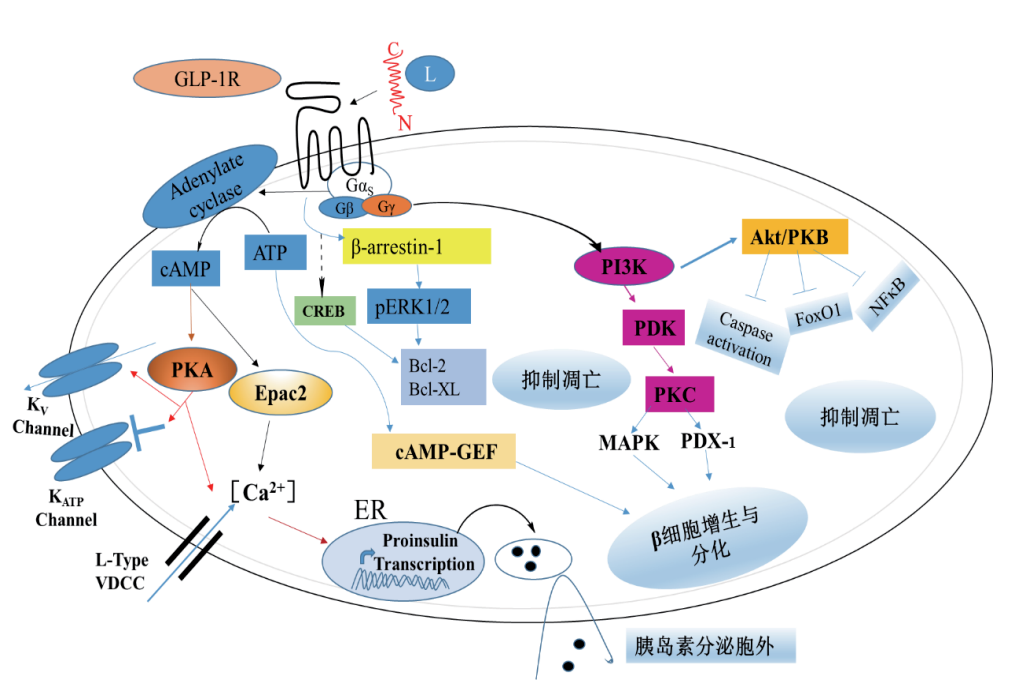
图1. 胰岛 β 细胞中 GLP-1R 调控的信号通路[10]
双荧光素酶报告基因系统(Dual-Luciferase reporter assay)
在进行荧光素酶报告基因实验时,细胞生长状态、细胞数目和转染效率在每次实验时不可避免会有细微差异,这多少会对结果的重复性带来一些挑战,为了最大程度上减少这些因素造成的影响,使得数据结果更加稳定准确,可以采用双荧光素酶报告基因系统。
双荧光素酶报告基因检测系统就是细胞同时表达萤火虫萤光素酶和海肾萤光素酶两种荧光素酶,两者催化各自的底物产生生物荧光,具体的反应原理参见图2。实验设计以萤火虫萤光素酶为核心Reporter,海肾荧光素酶作为内参,减少实验条件变化对检测结果的干扰。构建质粒时可以将萤火虫荧光素酶和海肾荧光素酶分别构建到两个质粒载体上,然后将两种质粒共转染细胞;也可以将这两种荧光素酶构建到同一个质粒上,但是需要用不同的启动子启动两种荧光素酶的表达[11]。质粒构建成功后转染细胞,检测时分别添加相应的荧光素酶底物,用荧光测定仪检测荧光强度。

图2. (A)萤火虫荧光素酶催化反应原理;(B)海肾荧光素酶催化反应原理[11]
总结
随着生物药检测技术的不断发展和创新,生物学活性检测方法也愈发纷繁多样,而报告基因法因其操作便捷快速、通量高、灵敏度高、干扰少等优势被广泛用于生物药的生物学活性检测。
报告基因法也收录在《中国药典》四部中:第3523条报告基因法为Ⅰ型干扰素活性测定的标准方法之一,第3535条康伯西普生物学活性测定也采用报告基因法。因此,报告基因法应用前景十分广阔。
参考文献:
[1]. 刘荔桢等.报告基因法在生物技术药物活性检测中的应用.China Pharmacist 2021.
[2]. Vincent Blay.et al.High-Throughput Screening: today’s biochemical and cell-based approaches.Journal Pre-proof.2012.doi:10.1016/j.drudis.2020.07.024
[3]. 张禾璇,单可人.报告基因研究及其应用进展.国际遗传学杂志. 2013.
[4]. Frank Fan.et al.Bioluminescent assays for high-throughput screening.Technology Review.2007.doi:10.1089/adt.2006.053.
[5]. Samuel A.et al.The Human Transcription Factors.Cell.2018.doi:10.1016/j.cell.2018.01.029.
[6]. Hamiyet Unal.et al.Luciferase reporter assay for unlocking ligand-mediated signaling of GPCRs.2019.doi: 10.1016/bs.mcb.2018.08.001.
[7]. 马晓芸,于金梅.cAMP反应原件荧光素酶报告基因载体构建.生物技术通讯.2013.
[8]. Zhilan Guo.et al.Construction and verification of NF-κB luciferase reporter gene system.Chin J Biotech.2016.
[9]. Cheng, Z.et al..Luciferase reporter assay system for deciphering GPCR pathways. Current Chemical Genomics. 2010.doi:10.2174/1875397301004010084.
[10]. Zhongping Hu.et al.Research Progress on Structure and Function of GLP-1R and Screening for Small Molecule Drugs. Biotechnology Bulletin.2017.
[11]. Sherf, B.A. et al.Dual-Luciferase® reporter assay: An advanced co-reporter technology integrating firefly and Renilla luciferase assays. Promega Notes.1996.

 企业邮箱
企业邮箱 企业OA
企业OA